迈入2022年的第一个月份,两个与细胞治疗产品密切相关的法规先后发布。 “双轨制”的监管效率已经无法匹配国内细胞疗法产业的变化。近年一系列举措均显示,“双轨制”有望转为作为药品进行规范监管的“单轨制”。
迈入2022年的第一个月份,两个与细胞治疗产品密切相关的法规先后发布。1月初,国家药监局继2019年之后再次发布《药品生产质量管理规范-细胞治疗产品附录(征求意见稿)》;临近月末,国家药监局药审中心(CDE)出台了《嵌合抗原受体T细胞(CAR-T)治疗产品申报上市临床风险管理计划技术指导原则》。
回顾2021年,我国在细胞治疗上已经迈出了可喜的一步,两款自体CAR-T治疗产品——复星凯特的阿基仑赛注射液和药明巨诺的瑞基奥仑赛注射液相继获批,成为首批作为药品批准的细胞疗法,2021年也因此被视为我国CAR-T细胞治疗产品的元年。
细胞治疗作为一种新型的免疫治疗方法,近年来在肿瘤治疗上发展迅速,也受到了资本的大力追捧。不过,不同于传统药品的是,细胞治疗来源于人体活细胞,在伦理、临床使用和监管上都带来了很大的挑战。而由于多方缘由,我国在细胞治疗的监管上一直实行“双轨制”:一方面,根据卫健委的相关法规,细胞疗法作为一种医疗技术,由卫生部门进行监管,医疗机构可依法自行决定临床应用;而另一方面,细胞治疗产品也可以作为药品,由药品监管部门进行临床准入监管审批。
“双轨制”引发问题
研发客在中国临床试验注册中心网站(http://www.chictr.org.cn/)查阅到有一千多项细胞治疗的IIT(研究者发起的临床研究)登记在案。与此相比,在CDE的药物临床试验信息共示与信息平台(http://www.chinadrugtrials.org.cn/)上登记的细胞治疗临床研究数量则不足一百。造成如此巨大差异的缘由正是监管的“双轨制”。
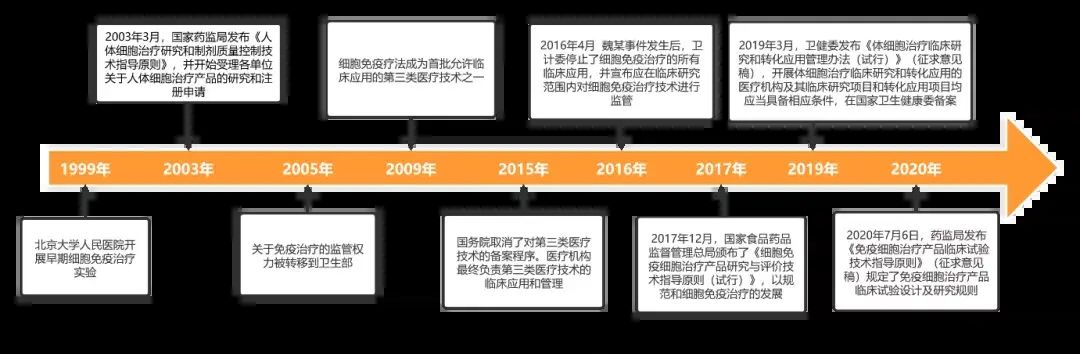
2009年,原国家卫生部颁布《医疗技术临床应用管理办法》和《首批允许临床应用的第三类医疗技术目录》,将免疫细胞治疗技术列为第三类医疗技术开展临床应用。细胞治疗进入了准入审批阶段。
来源|中伦律师事务所
不过,2015年,国家撤销了第三类医疗技术的临床应用审批,细胞治疗由于未被列入“首批允许临床应用的第三类医疗技术目录”,因此只能开展临床研究,不能进行临床应用。而根据2014年发布的《医疗卫生机构开展临床研究项目管理办法》,这类临床研究需实行医疗卫生机构立项审核制度,经医疗卫生机构批准立项的临床研究方可在该机构内实施。
细胞治疗从准入审批转为仅能开展临床研究,在这种情况下,开展细胞治疗的企业无法独立开展临床研究,只能与医疗机构合作开展。这也就是如此众多的细胞治疗IIT存在的缘由。
2014年后,以CAR-T细胞治疗为代表的新一代免疫细胞治疗在我国开始起步,涌现出一批相关的专注于细胞疗法的生物技术公司。为此,2017年12月,原国家食药监局出台了《细胞治疗产品研究与评价技术指导原则(试行)》,对细胞治疗产品作为药品开展临床研究、注册申请和产业化生产等做出详细规定。
由于2016年魏则西事件后,各地严令禁止了细胞治疗的临床应用,明确仅能开展临床研究,因此上述2017年药监局的法规出台之后,引发了细胞治疗产品IND申报潮,一批正在研发的细胞治疗产品纷纷申请临床试验,期望能走通药品注册之路。
不过好景不长,一年多后的2019年3月,国家卫健委发布了《体细胞治疗临床研究和转化应用管理办法(试行)》的征求意见稿。根据该征求意见稿,符合相应条件的医疗机构及体细胞治疗临床研究项目,可以在国家卫健委备案,并在备案项目范围内开展临床转化应用。
该办法若正式落地,则意味着细胞治疗可以通过第三类医疗技术的途径进入到临床使用。相对于药品注册途径,医疗技术备案明显更为简单快捷,因此征求意见稿发布后,众多提交IND申请的细胞治疗立即转向,回归与医疗机构联合开展IIT的模式,新申报的产品也变得屈指可数。
不过,直至今日,该征求意见稿仍未正式落地。而违规收费等问题却屡屡发生,引发安全性等问题。
新法规重点关注风险管理
2022年1月6日,国家药监局再次发布了《药品生产质量管理规范-细胞治疗产品附录》的征求意见稿,并征求意见至2022年2月7日。与2019年11月首次发布的征求意见稿相比,本次文件做了较大的改动。
该法规对细胞治疗产品做了明确的定义:“细胞治疗产品是指人源的活细胞产品,包括经过或未经过基因修饰的细胞,如自体或异体的免疫细胞、干细胞、组织细胞或细胞系等产品,不包括输血用的血液成分、已有规定的移植用造血干细胞、生殖相关细胞,以及由细胞组成的组织、器官类产品等。”
并且指出,细胞治疗产品与一般的药品不同,具有特殊性,例如,供者材料来源于人体,可能含有传染病病原体;质量具有差异性;生产批量一般较小,温度对质量的影响更为显著;容易受到微生物污染或交叉污染等。
鉴于这些特殊性,该法规提议企业应当对供者材料采集和产品生产的全过程采取特殊控制措施,从供者材料的接收直至成品储存运输的全过程进行风险评估,制定相应的风险控制策略,建立生物安全管理制度和记录,监控产品或生产环境的温度及操作时限,避免交叉感染,且产品应当予以正确标识且可追溯。
法规还具体说明了人员、厂房、设施与设备、供者筛查与供者材料、物料与产品、生产和质量管理等的具体要求。其中提到,企业应当与经认可的合格医疗机构签订质量协议。定期对医疗机构采集供者材料和使用产品的情况进行回顾和评估。法规还要求企业应当建立产品标识和追溯系统,对每一个供者编制具有唯一性的编号(或代码)。
而在细胞疗法中,CAR-T细胞治疗无疑是当前最热的。去年9月,国家药监局药审中心针对此类产品申报上市的临床风险管理计划发布了征求意见稿。在此基础上,2022年1月26日,药审中心正式出台了《嵌合抗原受体T细胞(CAR-T)治疗产品申报上市临床风险管理计划技术指导原则》。
与GMP细胞治疗产品附录类似,这个新发布的指导原则同样密切关注细胞疗法这一治疗产品的特殊性及其安全风险。该指导原则明确,CAR-T 细胞治疗产品申报上市风险管理计划的主要内容应包括安全性说明、药物警戒活动、上市后有效性研究计划、风险最小化措施。
该指导原则特别指出,除了与其他药品一样开展药物警戒活动外,还应采取针对CAR-T细胞治疗产品的特殊药物警戒活动,以识别、定性或定量描述CAR-T细胞治疗产品的安全风险,补充缺失信息,并建立起产品从生产、运输、使用到后续随访的全链条管理体系,实现可追溯。
此外,为了进一步降低CAR-T细胞治疗产品的安全风险、保护患者,还要采取额外风险最小化措施,如上市许可持有人对医疗机构的评估和认证、开展医务人员和患者的教育培训、发放患者提示卡等。当出现大量不良反应或出现新的安全性信息时,还需对教育材料进行评估和适时更新。
作为药品监管有助于行业发展
实际上,在去年2月和12月,CDE分别发布了《免疫细胞治疗产品临床试验技术指导原则(试行)》和《基因修饰细胞治疗产品非临床研究技术指导原则(试行)》这两部技术指导原则,分别对免疫细胞治疗产品和基因修饰细胞治疗产品的研发做了规范。
而在去年2月9日,国家卫健委在“对十三届全国人大三次会议第4371号提议的答复”中称,“我委一直鼓励和支持干细胞、免疫细胞等研究、转化和产业发展。干细胞、免疫细胞等细胞制剂具有明显的药品属性。国家药品监管部门已经为相关制剂通过药品审批制定配套政策,审批后可以迅速广泛应用,既有利于保障医疗质量安全,又有利于产业化、高质量发展。”
这一系列举措均显示,中国对细胞疗法的监管有望从“双轨制”转为作为药品进行规范监管的“单轨制”。而在全球范围内,将细胞治疗产品作为药品监管也是通用的做法,因此更有利于国内产业的规范发展和与国际接轨。
而行业和资本也已经迅速捕捉到这一信号。刚刚过去的1月,就有8家开展细胞治疗研发的企业获得融资。去年以来,CDE公示的细胞治疗IND逾20项。可以预见,监管规范化后,细胞治疗将会成为又一个新药研发的热点。

END
注:以上图文素材经授权整理自“研发客”公众号,版权归原作者及原出处所有,此文仅用作分享行业资讯用途,旨在知识/信息共享,所有内容代表作者/原创平台观点,本文仅供交流,不作商用,如有不当或涉及版权等问题,请及时联系后台,我们会及时处理。



















暂无评论内容